高中化学原电池是什么(化学能转电能,神奇原电池!)
标题:原电池的工作原理及氧化还原反应驱动电子定向移动
引言: 原电池是一种将化学能转化为电能的重要装置,其基本工作原理是通过氧化还原反应来驱动电子实现定向移动,从而闭合电路并产生电能。本文将系统介绍原电池的工作原理及其中涉及的氧化还原反应过程。
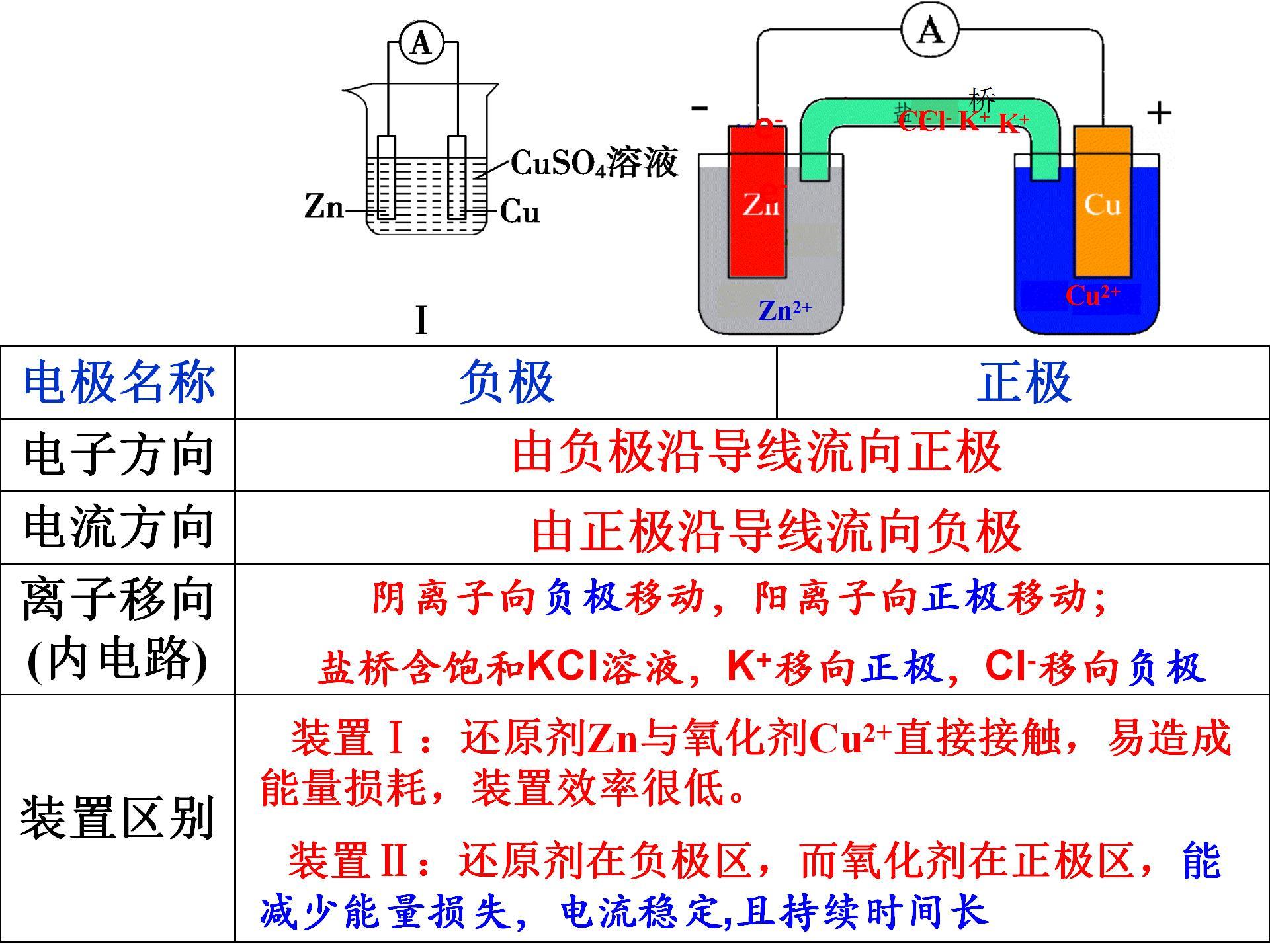
1. 电子移动方向: 电子是从负极流出,通过导线聚集到正极,形成电子的移动方向。与电子移动方向相反,电流从正极流向负极。
2. 内电路中的离子移动方向: 在电解质中,阴离子从负极移向正极,而阳离子从正极移向负极。这是因为在负极发生失电子反应,产生阳离子吸引阴离子,使其向负极移动;同时,电子在正极聚集,吸引阳离子向正极移动。
3. 反应类型与定向移动: 负极发生氧化反应,是失电子的还原剂反应;正极发生还原反应,是得电子的氧化剂反应。通过让这两种反应在不同电极上进行,利用导线实现电子定向移动,电解质溶液中的离子也完成定向移动,从而闭合整个电路。
4. 氧化还原反应驱动电子定向移动: 氧化还原反应是原电池中驱动电子定向移动的关键。通过在不同电极上分别进行氧化和还原反应,电子在外电路中产生定向移动,电解质中的离子也实现定向移动,从而完成电路闭合,实现化学能向电能的转化。
结论: 原电池是一种将化学能转化为电能的装置,其工作原理是通过氧化还原反应来实现电子的定向移动。通过在不同电极上进行氧化和还原反应,以及电解质中离子的定向移动,原电池能够将化学反应产生的能量转化为实用的电能。这一原理在现代电池技术中得到广泛应用,为能源领域带来了重大突破。
