高中化学原电池是什么(化学能转变电能,揭秘原电池工作原理!)
原电池的工作原理
化学能可以转化为热能,那么它能够直接转化为电能吗?答案是肯定的。在这篇文章中,我们将介绍原电池的工作原理,它是一种将化学能转化为电能的装置。
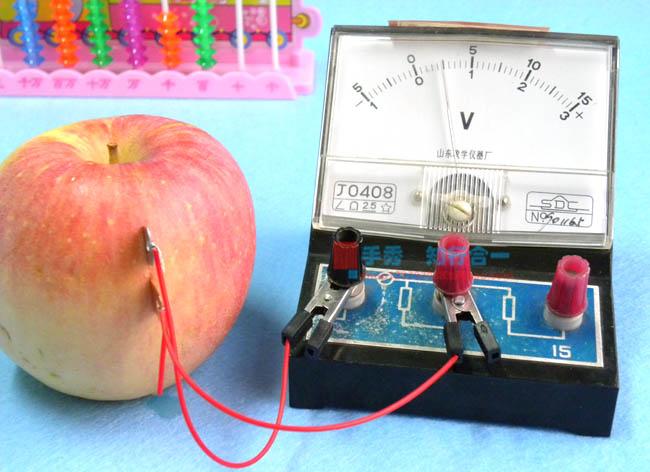
实验现象
首先,进行一个实验。将芯片插在左边,铜片插在右边,然后用导线连接它们,并插入一个电流计观察。实验结果显示,在铜片上会产生气泡溢出,并且电流计的指针偏转到了一侧。换句话说,电子从锌流向了铜。根据物理学的说法,这是因为电子从低电位流向了高电位。
金属的内部结构
为什么铜的电位比锌的电位高呢?是因为硫酸的作用吗?显然不是,因为它们都是置于硫酸溶液中的,所以环境是相同的。区别在于两种金属本身。让我们来看一下金属的内部结构。金属由金属阳离子和自由电子组成,阳离子整齐有序地排列,而电子在空隙中自由移动。如果将金属放在溶液中,阳离子是可以进入溶液的,因为它们在金属上的浓度非常大。根据浓度差原理,它们会进入溶液中扩散。然而,电子不能进入溶液中,它们只能留在金属中,就像鱼只能在水中生存一样。因此,阳离子会扩散到溶液中,而电子则会拽着其他阳离子不让它们扩散。这导致阳离子只能扩散到一定程度,否则金属就会完全溶解。然而,人眼无法察觉到阳离子只扩散到一层。那么实验现象是怎么产生的呢?
锌和铜的活泼程度
实验现象是由于锌比铜更活泼,也就是说锌更容易失去电子,相反,铜对阳离子的吸引力更小。这意味着锌中的阳离子扩散趋势大于铜,因此锌带上的负电比铜多。可以说新的电位低于铜,因此电子沿着导线流向铜。由此,铜的电位下降,新的电位上升。然而,总有一个时刻电位会相等,电子就无法再流动了,这样就只能产生瞬间的电流。
硫酸的作用
但是,为什么实验中观察到电流计指针一直偏转呢?这是因为硫酸起了作用。一开始,电子在锌上带着锌离子不让它们扩散。然而,当电子流向铜后,锌离子就溜进溶液中,并将氢离子挤到铜的一侧。这将硫酸根吸引到锌的一侧。与此同时,溶液中的氢离子得到电子并释放氢气。这使得电子的数量不再增多,电位也不再下降。然而,在锌进入溶液后,锌表面的阳离子继续向溶液中扩散,电位也不再上升。因此,电子持续从锌流向铜,而氢离子和硫酸根则在溶液中定向移动,形成了一个闭合回路。这就是原电池形成的原理。
正极和负极
失去电子的一极被称为负极,而得到电子的一极称为正极。在这个例子中,锌是负极,发生了氧化反应。而氢离子在阳极表面得到电子并产生氢气,它是正极,发生了还原反应。总的反应式如下:
Zn + 2H+ → Zn2+ + H2
值得注意的是,在溶液中,阳离子向正极移动,而阴离子向负极移动。这与我们以前的理解恰好相反,请不要弄混。
原电池的形成条件
正如我们所提到的,原电池的实质是将一个氧化还原反应的失电子和得电子的部位分开。因此,构成原电池必须有一个自发的氧化还原反应。从理论上讲,任何一个氧化还原反应都可以设计成一个原电池。
以上就是原电池的工作原理。关于它的形成条件,我们将在下一篇文章中讨论。
