初中化学的放热物体是什么(惊人实验证明:溶解过程竟伴随神奇能量变化!)
化学反应中的能量变化
化学反应伴随着能量的变化,有的放热,有的吸热。我们可以通过实验观察这些变化来了解不同物质在溶解过程中的能量变化。
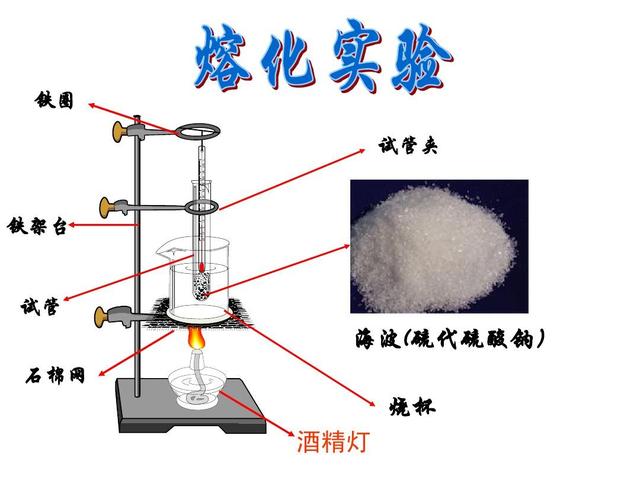
实验材料与步骤
首先,我们准备了三个烧杯,每个都装有等量的水,并测得温度均为24度。接着,我们分别向这三个烧杯中加入不同的物质,并观察温度的变化。
-
氯化钠的溶解:向一号烧杯中加入六克氯化钠,轻轻搅拌。观察结果:温度没有显著变化,表明氯化钠的溶解没有明显的热量变化。
-
硝酸铵的溶解:向二号烧杯中加入六克硝酸铵,轻轻搅拌。观察结果:温度降低,说明硝酸铵的溶解吸热。
-
氢氧化钠的溶解:向三号烧杯中加入六克氢氧化钠,轻轻搅拌。观察结果:温度显著升高,说明氢氧化钠的溶解放热。
吸热和放热的物质
在实验中,我们发现不同物质在溶解过程中表现出吸热和放热的特性。具体来说,硝酸铵是吸热物质,而氢氧化钠、浓硫酸以及氧化钙都是放热物质。
氧化钙的反应
值得一提的是,氧化钙(生石灰)在与水反应时放热,产生氢氧化钙,这个反应非常剧烈,伴随着气泡的产生,就像煮沸一样。因此,氧化钙的溶解过程也伴随着显著的放热现象。
其他产生气体的反应
除了吸热和放热的物质外,我们还可以通过固体和液体的反应来生成气体,从而增加容器内部的压强,使气球鼓起来。以下是一些可行的反应:
- 使用固体二氧化锰和液体过氧化氢溶液反应,生成氧气。
- 使用固体大理石和液体稀盐酸反应,生成二氧化碳。
- 使用活泼金属(如钠或铝)与酸(如盐酸或稀硫酸)反应,生成氢气。
结论
通过这个实验和分析,我们可以得出结论:溶解过程中常伴随着吸热或放热的现象。吸热的物质包括硝酸铵,放热的物质包括氢氧化钠、浓硫酸和氧化钙。此外,通过特定的反应,我们还可以生成气体,使容器内部压强增加,从而使气球鼓起来。这些实验结果帮助我们理解了化学反应中的能量变化。
